Les solutions acqueuses
1 Définitions
Des substances sont solubles avec une autre substance si elles forment avec elle un mélange homogène. Le corps mis en solution est un soluté. Le corps dans lequel le soluté est dissous est le solvant. Le mélange du soluté et du solvant est la solution.
La concentration molaire d’une solution met en rapport la quantité de matière dissoute
et le volume de solvant dans lequel le soluté a été dissous. Elle se calcule comme suit :
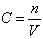
avec C, concentration molaire en mol.l-1
n, quantité de matière dissoute en mol.
V, volume de solvant en litres
On peut facilement retrouver la quantité de soluté introduite à partir de la masse introduite et de la masse molaire du corps.
En effet, 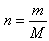 .
.
La concentration molaire ionique doit être calculée en fonction de la concentration molaire et des coefficients stœchiométriques de l’équation bilan. En effet, si la dissolution d’un atome donne naissance à deux ions, on aura Cion= 2. C. La concentration molaire d’un ion i se note [i].
L’électroneutralité est la caractéristique constante d’une solution. En effet, la solution est obtenue par dissolution d’un soluté électriquement neutre et le nombre de moles de charges négatives dues aux anions est strictement égal au nombre de charges positives dues aux cations. Cette égalité est valide pour les quantités, elle l’est donc tout autant pour les concentrations molaires ioniques puisque le volume de solution est le même.
2 Préparation des solutions aqueuses, dilutions
La préparation des solutions aqueuses ou leur dissolution doit suivre certaines procédures afin de ne pas aboutir à une solution dont la concentration nominale est erronée ( voir la fiche méthode en fin de leçon).
Le principe de la dissolution veut que, pour obtenir une solution fille Sf de concentration Cf, on dilue un volume Vm de la solution mère Sm de concentration Cm qui est nécessairement plus forte que celle de Sf. On ne peut évidemment pas aboutir par dissolution à une solution fille plus concentrée que la solution mère. Le volume de solution mère à dissoudre est à choisir judicieusement en fonction de la concentration de la solution que l’on désire obtenir et du volume de solution fille dont on souhaite disposer.
La loi de conservation chimique permet d’affirmer que la quantité de matière présente dans
l’échantillon de la solution mère qui a été dissoute est toujours présente dans l’ensemble de
la solution fille.
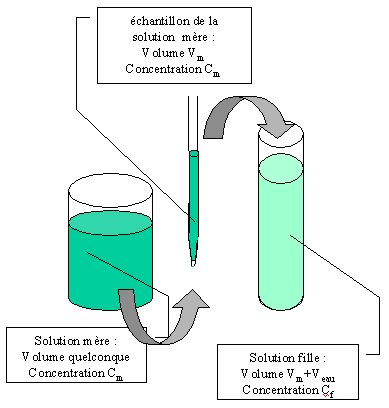
On peut mettre cette conservation sous forme mathématique en affirmant que :
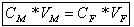
3 La dissolution des composés ioniques dans l'eau
Un corps pur ionique contient au moins deux sortes d’ions : l’un positif, l’autre négatif. Ils sont toujours en quantités équivalents de sorte que le corps pur est électriquement neutre.
Entre ces ions règne un autre type de liaison que les liaison covalentes abordées l’an
dernier. Il y a ce que l’on appelle une liaison ionique qui résulte de l’attraction entre
les ions due aux charges électrostatiques.
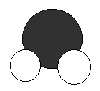
La molécule d’eau se présente ainsi que le montre la figure ci-dessus. Elle est caractérisée par une polarité.
En effet, l’atome d’oxygène a des propriétés électronégatives qui font que les doublets le liant aux atomes d’hydrogène se déplacent vers l’atome d’oxygène. A l’opposé de l’atome d’oxygène, les deux doublets non-liants ne permettent pas de rééquilibrer la molécule par une charge positive.
Ainsi, si la molécule reste neutre électriquement, elle présente une charge négative de -2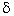 sur
l’atome d’oxygène et de +
sur
l’atome d’oxygène et de +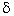 sur chacun des atomes d’hydrogène. On dit qu’elle est polaire.
sur chacun des atomes d’hydrogène. On dit qu’elle est polaire.
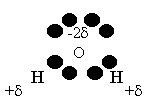
Ce sont ces propriétés qui font que l’eau parvient à briser la liaison ionique et à les disperser.
En effet, les ions positifs attirent l’atome d’oxygène de la molécule d’eau puisqu’il est porteur de
la charge –2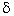 . Les ions négatifs, eux sont attirés par les atomes d’hydrogènes qui sont porteurs de la
charge partielle +
. Les ions négatifs, eux sont attirés par les atomes d’hydrogènes qui sont porteurs de la
charge partielle +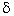 . On arrive à une solution qui peut-être schématisée ainsi :
. On arrive à une solution qui peut-être schématisée ainsi :
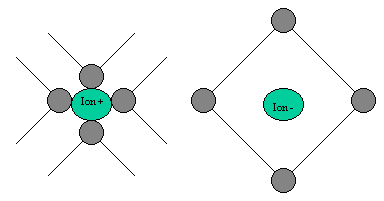
Cette interaction du solvant et des ions est appelée solvatation des ions, dans le cas d’un
solvant eau, on l’appelle aussi hydratation. L'équation bilan d'une hydratation se présente comme
ceci :
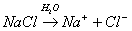
4 Pour aller plus loin (hors programme)
On distingue les substances hydrophobes qui ne sont pas solubles dans l’eau des substances hydrophiles qui le sont. Ces derniers sont des molécules polaires alors que les substances non solubles sont des molécules apolaires.
Les composés moléculaires subissent une dissolution avec ionisation. Trois grandes réactions peuvent intervenir : une formation de solution acide, une formation de solution basique ou une ionisation simple. Dans ces trois cas, l’ionisation peut être totale ou partielle.
Une molécule de soluté peut abandonner un ou plusieurs protons qui sera(ont) capturé par le doublet
non liant de l’atome d’oxygène de la molécule d’eau ( la charge partielle négative). On arrive donc à
une équation bilan du type :
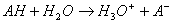
Il y a bien création d’une solution acide ( ions H3O+)
A contrario, le solvant eau peut être amené à céder un proton qui sera capté par un doublet non liant
de la molécule de soluté. Dans ce cas là, on débouche sur une molécule OH- qui est le propre des solutions
basiques :
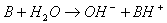
On dit que l’ionisation est totale si toutes les molécules de soluté introduites dans l’eau ont participé à l’ionisation c’est à dire qu’il n’en reste aucun sous forme initiale. Cette ionisation totale est constatée dans l’équation-bilan par une flèche unique vers la droite.
En revanche, s’il reste des molécules de soluté dans la solution, c’est qu’une partie seulement du soluté a subi l’ionisation. Dans ce cas, on parle d’ionisation partielle, qui se traduit par une flèche à double sens.
N.B. :Dans les deux cas des dissolution ioniques et de composés moléculaires, il y a des conséquences thermiques qui seront traitées dans le cadres de la leçon sur la calorimétrie des réactions chimiques.
Il faut noter que la solubilité n’est pas identique pour tous les ions et tous les composés moléculaires : on appelle limite de solubilité ou solubilité la masse m maximale de soluté qui peut se dissoudre dans un litre de solvant donné. On dit alors que la solution est saturée. On considère que le soluté n’est pas soluble si cette valeur est inférieure à 0, 01 mol.l-1.
Fiche-méthode : la dissolution en TP
Pour réaliser un dissolution au dixième ( c’est à dire obtenir une solution titrant le dixième de la concentration de la solution mère :
- laver soigneusement la verrerie à l’eau distillée et le sécher parfaitement ( une verrerie non lavée peut contenir des traces de produits qui fausseront la concentration, un résidu d’eau impure en fera autant)
- prélever un volume de 10 ml de la solution mère avec une pipette graduée en s’aidant le cas échéant d’une pro-pipette.
- l’introduire dans une fiole jaugée de 100 ml
- compléter jusqu’au trait de jauge avec de l’eau distillée.
- il convient de bien mélanger afin d’obtenir une solution homogène.
Les difficultés de la leçon :
Ce qu’il faut savoir :
- la loi de conservation et son application
- les formules de la masse en fonction de la quantité et réciproquement ( en faisant intervenir la masse molaire) : le cours de seconde est considéré comme acquis.
Ce qu’il faut savoir faire :
- décrire un TP
- équilibrer une équation-bilan
- réaliser des calculs sans se tromper dans les unités ( conversion des mL en L et des cm3 et L )
- raisonner logiquement et par étape ( calculer la quantité dissoute puis la concentration de la solution mère puis la quantité présente dans l’échantillon prélevé, puis la concentration de la solution fille, …