Electrolyse et générateurs électrochimiques
1 Définitions
1.1 Electrolyse
L'électrolyse met en jeu deux couples rédox. Il les fait réagir dan le sens contraire de la réaction naturelle au moyen d'un courant électrique qui apporte l'énergie nécessaire à la réaction.
Un électrolyseur est un dispositif consistant en une récipient contenant une solution ionique dans la quelle plongent deux électrodes.
Les électrodes se polarisent dès que le courant passe :
- L'anode est l'électrode par laquelle le courant arrive dans le système. Les électrons en sortent donc. Il y a oxydation du réducteur. Elle est reliée au pôle + du générateur.
- La cathode est l'électrode par laquelle sort le courant c'est à dire par laquelle entrent les électrons. Il s'y produit. Elle est reliée au pôle - du générateur.
Contrairement aux piles vues dans le chapitre sur le potentiel standard, le dispositif d'électrolyse n'est pas polarisé par les couples rédox mais bien par le générateur branché à ses bornes.
L'électrolyte est le milieu conducteur, la solution ionique dans laquelle baignent les anions et les cations.
Les anions de l'électrolyte migrent vers l'électrode reliée au pôle + ( l'anode) et y subissent parfois une réaction d'oxydation.
Les cations de l'électrolyte migrent vers l'électrode reliée au pôle - ( c'est à dire la cathode) où ils peuvent subir une réduction.
Il peut enfin y avoir éventuellement oxydation ou réduction de l'eau (voir ci-dessous les couples rédox de l'eau).
Les participants potentiels aux échanges électroniques sont donc :
- les ions positifs ou négatifs du bain électrolytique
- les molécules du solvant
- les matériaux constituant les électrodes
1.2 Couples rédox de l'eau
H2O peut subir une réduction à la cathode d'un électrolyseur.
- En milieu acide, le couple mis en jeu est H+/H2O selon l'équation
- En milieu basique, le couple mis en jeu est H2O/H2 selon l'équation
H2O peut subir une oxydation à l'anode de l'électrolyseur :
- en milieu acide, le couple rédox mis en jeu est : O2/H2O selon l'équation
- en milieu basique, le couple mis en jeu est : O2/OH- selon l'équation
2 Prévision théorique des résultats de l'électrolyse
Même si plusieurs espèces ioniques de chaque signe sont présentes dans la solution,
- l'oxydant ayant le plus fort potentiel rédox est réduit à la cathode.
- Le réducteur ayant le potentiel rédox le plus faible est oxydé à l'anode
On a donc une réaction qui est inverse à la règle du gamma.
Pour ce, il faut fournir une f.e.m. pour contrer celle qui se manifeste naturellement. En effet, les réactions de l'électrolyse allant dans le sens opposé au sens naturel, ses produits sont précisément les réactifs de la réaction naturelle. Il faut fournir une tension qui empêche cette dernière d'avoir lieu.
En effet, au fur et à mesure de la formation des produits par l'électrolyse, la réaction naturelle tend à les détruire et à créer une tension inverse à celle fournie. Il convient donc de l'éviter en fournissant une tension suffisante.
La f.e.m. du générateur utilisé doit être supérieure à la f.e.m. de la pile qui serait montée à partir des deux couples rédox utilisés. Le générateur voit ses polarités inversées par rapport à ce que seraient celles de la pile créée à partir des deux piles. L'électrolyse se déroulera à partir d'une f.e.m. du générateur supérieure ou égale à la différence des potentiels des deux couples rédox.
ATTENTION : il arrive fréquemment que ces règles soient prises en défaut, notamment parce que les réactions théoriques sont des réactions lentes ou parce qu'elles demandent une surtension par rapport à celle prévue.
Ces différences peuvent s'expliquer :
- les potentiels standards rédox utilisés dans les calculs sont différents des potentiels effectifs parce que l'expérience n'est pas réalisée dans les conditions standard.
- La vitesse de certaines réactions chimiques d'oxydation ou de réduction notamment lors de dégagement gazeux est lente au niveau des électrodes. Il faut alors un apport d'énergie supplémentaire ou surtension.
3 Les accumulateurs / Les générateurs électrochimiques
3.1 Accumulateur / Générateur électrochimique
Un accumulateur est un dispositif électrochimique qui peut fonctionner comme :
- un récepteur électrochimique lorsqu'il joue le rôle d'un électrolyseur. Il se charge grâce à l'énergie électrique apportée par un autre générateur.
- un générateur électrochimique lorsqu'il fonctionne comme une pile simple ( c'est à dire dans le sens naturel de l'oxydoréduction ) : il se décharge.
Exemple d'un accumulateur-type :
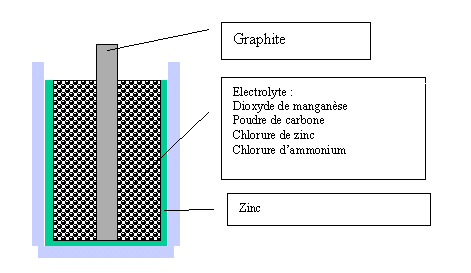
La pile Leclanché
Elle se compose :
- d'une anode en zinc conducteur
- d'une solution gélifiée de chlorure de zinc et de chlorure d'ammonium
- d'une cathode constituée d'un bâton de graphite poreux entouré de dioxyde de manganèse, un oxydant non conducteur.
Les réactions mises en jeu sont :
- à l'anode :
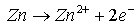
Les électrons libérés partent dans le circuit électrique.
- Dans l'électrolyte :
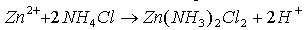
- à la cathode :
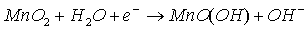
Il faut noter qu'il y aura un dégagement gazeux de dihydrogène du aux ions H+. Ce dégagement est absorbé par le bâton de graphite.
Cette pile est dite irréversible parce qu'on ne peut pas provoquer les réactions inverses.
La f.e.m. d'un générateur électrochimique est évidemment égale à celle de la pile qu'on composerait avec les deux couples en présence. Pour réaliser la charge, il faut fournir une tension supérieure à cette f.e.m. naturelle.
Normalement les accumulateurs sont réversibles : ils peuvent se comporter comme des récepteurs ou des générateurs. c'est par exemple le cas pour un accumulateur au plomb que l'on peut monter très simplement.
L'accumulateur au plomb
Il met enjeu les couples Pb2+/Pb et PbO2/Pb2+.
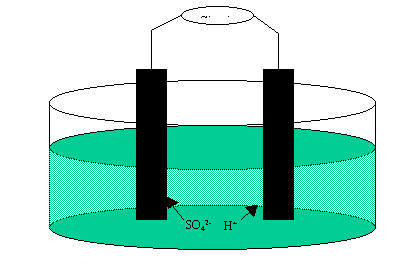
Les électrodes tendent à devenir symétriques à la fin de la décharge :
On a sur l'anode :
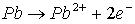 puis.
puis.
Il y a réduction cathodique sur la plaque positive :
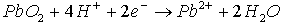 puis.
puis.
Le premier couple a un potentiel de -0, 13 V. Le second de +1, 45 V. La f.e.m. du générateur ainsi obtenu est de 1, 58 V.
On peut juxtaposer plusieurs accumulateurs de ce type et les placer en série pour obtenir une pile dotée d'une f.e.m. plus grande.
3.2 Méthodologie pour un exercice sur l'électrolyse
Méthodologie pour un exercice sur l'électrolyse
Pour étudier la formation ou la disparition d'une quantité de matière :
- préciser le coupe rédox mis en jeu et écrire la demi-équation électronique correspondante.
- En déduire s'il y a formation ou disparition de matière aux électrodes
- Exprimer la relation entre quantité d'électricité Q qui circule et la quantité d'électrons échangés.
- A l'aide de l'équation-bilan, déduire de ce qui précède la relation entre quantité de matière formée ou passée en solution, et quantité d'électricité qui circule.
Les difficultés de la leçon
- toujours bien connaître les concepts
- bien, identifier les couples et les réactifs mis en jeu dans l'électrolyse.
- prendre en compte les valeurs ALGEBRIQUES dans le calcul des f.e.m.
- bien distinguer les deux phases de l'accumulateur : charge ( identique à l'électrolyse) et décharge ( assimilée à la réaction rédox classique)