Cinétique et catalyse d'une réaction
1 Oxydation des ions iodure par l'eau oxygénée
1.1 L'eau oxygénée : un antiseptique usuel
L’eau oxygénée, la teinture d’iode, la liqueur de Dakin figurent parmi les antiseptiques les plus employés par voie externe. Les antiseptiques agissent le plus souvent en tant qu’oxydants. L’eau oxygénée est une solution aqueuse de peroxyde d’hydrogène de formule moléculaire brute H2O2 et de formule développée H—O—O—H.
1.2 Etude thermodynamique théorique
La comparaison des potentiels standards des couples H2O2/H2O et I3-/I- permet de prévoir l’oxydation spontanée des ions iodure I- en ions triiodure I3- par le peroxyde d’hydrogène H2O2 selon l’équation bilan : H2O2+3I-+2H+ -> 2H2O+I3-. L’ion I3- colore en brun la solution initialement incolore. L’apparition progressive de la couleur brune montre que la réaction entre I- et H2O2 est lente. L’examen de la coloration permet de déterminer la concentration en ions I3- formés.
1.3 Etude cinétique expérimentale
a) Suivi de la réaction par spectrophotométrie
Le suivi cinétique peut se faire qualitativement par l’examen visuel de la coloration du
mélange réactionnel ou quantitativement par spectrophotométrie. Un spectrophotomètre mesure
l’absorbance A d’une solution contenant une substance absorbante S et traversée par une lumière
monochromatique de longueur d’onde l. Selon la loi de Beer-Lambert, à température q donnée, il
y a proportionnalité entre A et [S] :
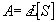
avec L (en cm) épaisseur de solution traversée, [S] (en mol.L-1) concentration de S et e (en mol-1.L.cm-1) coefficient dépendant de l, S et q.
Le suivi cinétique par spectrophotométrie de la réaction entre I- et H2O2 permet de tracer le graphe [I3-] = f(t). Le produit I3- apparaissant au cours du temps, la fonction f(t) est croissante.
b) Vitesse de formation de l’ion triiodure
On appelle vitesse moyenne de formation de l’ion I3- entre t1 et
t2 le rapport :
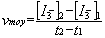
On appelle vitesse de formation de l’ion I3- à la date t, la valeur prise par
la dérivée de la fonction [I3-] = f(t) à cette date :
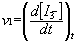
Cette vitesse instantanée est mesurée graphiquement par la pente de la tangente au graphe [I3-] = f(t) à la date t.
c) Vitesse volumique de disparition du peroxyde d’hydrogène
A tout instant, la concentration du réactif H2O2 s’exprime en fonction de la concentration du produit I3- par la relation : [H2O2]t = [H2O2]0 - [I3-]t.
La fonction [H2O2] = g(t) est décroissante. La vitesse volumique instantanée de
disparition du réactif H2O2 est définie par l’expression :
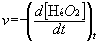
Cette vitesse instantanée est mesurée graphiquement par l’opposé de la pente de la tangente au graphe [H2O2] = g(t) à la date considérée.
Le temps de demi-réaction t1/2 est le temps nécessaire pour que la moitié de l’eau oxygénée
introduite à la date t = 0 ait réagi :
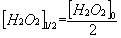
2 Vitesse d'évolution d'une espèce chimique
2.1 Cas général
La réaction d’équation bilan a A+b B -> g C+d D fait passer les réactifs A et B aux produits C et D. Pour suivre cette réaction de stœchiométrie connue, il suffit de suivre l’évolution de la quantité de matière n d’un produit P ou d’un réactif R au cours du temps.
La vitesse moyenne de formation du produit P pendant la durée 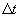 est définie par le rapport :
est définie par le rapport :
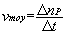
La vitesse moyenne de disparition du réactif R pendant la durée 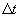 est définie par l’expression :
est définie par l’expression :
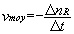
La vitesse instantanée de formation du produit P à la date t est définie par la relation :
Cette vitesse est égale au coefficient directeur de la tangente au graphe nP = f(t) à la date t.
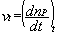
La vitesse instantanée de disparition du réactif R à la date t est définie par la relation :
Cette vitesse est égale à l’opposé du coefficient directeur de la tangente au graphe nP = f(t).
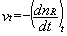
2.2 Cas particulier courant
Lorsque le mélange réactionnel est homogène et de volume constant, on peut définir la vitesse d’évolution d’une espèce E à partir de sa concentration.
Vitesse volumique moyenne de formation d’un produit P :
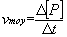
Vitesse volumique moyenne de disparition d’un réactif R :
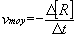
Vitesse instantanée de formation d’un produit P :
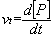
Vitesse instantanée de disparition d’un réactif R :
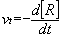
Le temps de demi-réaction t1/2 est le temps nécessaire pour que la moitié du réactif A introduit à la
date t = 0 ait réagi.
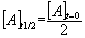
3 Facteurs cinétiques
Un facteur cinétique permet d’agir sur la vitesse d’une réaction thermodynamiquement possible. Concentration des réactifs et température sont deux facteurs cinétiques essentiels. Les données thermodynamiques permettent de prévoir que la réaction d’oxydation des ions peroxodisulfate S2O82- est spontanée et totale : S2O82-+3I- -> 2SO42-+I3-
La coloration progressive en jaune marron du milieu réactionnel par les ions I3- montre que cette réaction est lente. La concentration [I3-]t est directement liée à la coloration du mélange. Pour comparer des vitesses moyennes, on peut comparer les temps mis par différents mélanges à prendre une teinte donnée. On peut aussi comparer les teintes prises par différents mélanges à une date donnée. On observe que la réaction est d’autant plus lente que la concentration initiale en ions S2O82- est faible ou que la concentration initiale en ions I- est faible. La comparaison des temps mis par une même quantité d’ions triiodure à se former à différentes températures montre que la réaction est d’autant plus rapide que la température est plus élevée.
En conclusion, en général, la vitesse d’évolution d’une réaction chimique croît avec la concentration initiale de ses réactifs et est indépendante de la concentration de ses produits. De plus, elle croît avec la température.
4 Catalyseurs
4.1 Définitions
a) Catalyseur
C’est une substance qui accélère une réaction sans intervenir dans le bilan réactionnel.
b) Catalyse hétérogène
La catalyse est dite hétérogène lorsque le catalyseur et le mélange réactionnel forment des phases distinctes.
c) Catalyse homogène
La catalyse est dite homogène lorsque le catalyseur et le mélange réactionnel constituent une seule phase.
d) Autocatalyse
Une réaction est autocatalysée lorsqu’un (ou plusieurs) produit de la réaction est un catalyseur de cette réaction.
4.2 Caractères généraux de la catalyse
Un catalyseur ne permet pas à une réaction thermodynamiquement impossible de se produire. Un système cinétiquement inerte peut évoluer très rapidement en présence d’un catalyseur. Le catalyseur a seulement remplacé un profil réactionnel à grande barrière d’énergie par un profil réactionnel plus complexe, mais faisant intervenir des barrières d’énergie plus faibles.
4.3 Catalyse homogène
La décomposition très lente de l’eau oxygénée peut-être catalysée par les ions Fe3+. L’évolution de la coloration de la solution permet de penser que les ions Fe3+ participent à la réaction mais sont régénérés en fin de réaction. Les ions Fe3+ ont catalysé la dismutation du peroxyde d’hydrogène et sont régénérés en fin de réaction. En catalyse homogène, le catalyseur participe à la réaction en étant d’abord consommé puis régénéré. Le catalyseur facilite donc le passage de l’état initial à l’état final, le rendant ainsi plus rapide.
4.4 Catalyse hétérogène
La décomposition de l’eau oxygénée peut être favorisée par l’introduction d’un fil de platine ou d’argent : la catalyse est donc hétérogène.
Une catalyse hétérogène se fait en trois étapes :
- adsorption des réactifs à la surface du catalyseur
- réaction entre les réactifs adsorbés
- désorption des produits formé
4.5 Catalyse enzymatique
Les enzymes sont des catalyseurs biochimiques de nature protéique. Le substrat est la molécule subissant la réaction enzymatique. Les enzymes sont beaucoup plus actives que les catalyseurs chimiques. Très souvent, une enzyme ne peut catalyser la transformation que d’un substrat donné. Généralement, une enzyme ne peut accélérer qu’un type donné de réaction pour son substrat.