Acides et bases
1 Obtention d'une solution d'acide fort et de base forte
1.1 Acide chlorhydrique
On appelle acide tout composé susceptible de céder un proton. Le chlorure d’hydrogène HCl se dissout très facilement dans l’eau. Il est complètement dissocié dans l’eau en ions hydronium H3O+ et en ions chlorure Cl-, il s’agit d’un acide fort. La dissolution peut être décrite par l’équation bilan :
HCl + H2O -> Cl- + H3O+
1.2 Solution de soude
Une base est un composé susceptible de capter un proton. L’hydroxyde de sodium (ou soude) est complètement dissocié dans l’eau en ions Na+ et en ions hydroxyde OH-, il s’agit d’une base forte. La dissolution de la soude dans l’eau est décrite par l’équation bilan :
NaOH (eau) -> Na+aq+OH-aq
2 Réaction acide fort - base forte
La réaction entre un acide fort et une base forte est une réaction rapide et totale. Elle dégage 57 kJ par mole de réactif. Une solution de chlorure d'hydrogène réagit sur une solution de soude suivant l’équation bilan :
H3O+ + Cl- + OH- + Na+ -> 2H2O + Na+ + Cl-
Une mole d’acide chlorhydrique réagit sur une mole de soude. La réaction prépondérante est : H3O+ + OH- -> 2H2O
Lorsque l’on ajoute progressivement la base à l’acide, ou inversement, l’étude de la variation du pH du premier réactif au cours du versement progressif du deuxième réactif montre que le pH ne change pratiquement pas au début. En revanche, il varie de manière importante lorsque le volume atteint le volume équivalent.
On appelle équivalence l’état dans lequel les réactifs sont mélangés dans les proportions stœchiométriques. Si l’on construit la courbe représentant le pH en fonction du volume versé de base, le point correspondant à l’équivalence est appelé point équivalent. La relation d’équivalence s’énonce : CaVa = CbVb, avec Ca et Va concentration et volume de l’acide, Cb et Vb concentration et volume de la base. Le point d’équivalence peut être déterminé avec un pH-mètre ou avec les indicateurs colorés. Ainsi, lorsque l'on a tracé la courbe Vb = f(pH) à l’aide d’un pH-mètre, on utilise ensuite la méthode des tangentes : on trace deux tangentes à la courbe, parallèles entre elles et situées de part et d’autre du point d’équivalence, on construit la parallèle équidistante à ces deux tangentes et l’intersection de cette troisième parallèle avec la courbe constitue le point d’équivalence. Son abscisse donne le volume à l’équivalence.
3 Notion de couple acide-base
Toutes les molécules CH3COOH de l’acide éthanoïque ne réagissent pas avec l’eau : on dit que l’acide éthanoïque est un acide faible. Par rapport à un acide fort, de même concentration, la solution d’acide éthanoïque est moins acide et présente donc un pH plus élevé. De même, il existe des bases qui ne réagissent que de façon limitée dans l’eau (comme l’ammoniac NH3 ou l’ion acétate CH3COO-) : ce sont des bases faibles.
L’acide éthanoïque réagit avec l’eau pour donner l’ion acétate (ou éthanoate) ; de même l’ion acétate (ou éthanoate) réagit avec l’eau pour donner l’acide éthanoïque. Acide éthanoïque et ion acétate sont donc associés par la réaction acido-basique. On dit qu’ils constituent un couple acido-basique. On dit que A et B constituent un couple acide - base si les espèces A et B sont conjuguées, c’est-à-dire liées par la relation : A <-> B+H+. Dans l’eau, on observe l’équilibre :
A+H2O <-> B+H3O+.
On pose par définition pour le couple acide – base A/B :
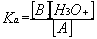
Ka est appelée constante d’acidité du couple A/B et la quantité –log(Ka) est appelée pKa du couple. Un acide est d’autant plus fort que son pKa est faible. Réciproquement, une base est d’autant plus forte que son pKa est fort. Plus un acide est fort, plus sa base conjuguée est faible.
4 Réaction acide faible - base forte
Lors de la réaction entre l’acide éthanoïque (acide faible) et la soude (base forte), le graphe de la variation du pH en fonction du volume de solution de soude versée fait apparaître quatre zones dont deux seront exploitées lors des manipulations. Le saut du pH inclut le point d’équivalence. Il est moins important que dans le cas de la réaction d’un acide fort avec une base forte ( a condition que les concentrations soient les mêmes dans les deux cas ). Avant cette zone, on observe un palier où la variation de pH est légèrement croissante.
Le point dont la valeur d’abscisse est la moitié de celle du point équivalent est appelé point de demi-équivalence. C’est un point d’inflexion et il correspond au minimum de variation du pH en fonction du volume de la solution de base ajouté
5 Prévision des réactions acide - base
Un acide A1 réagit sur une base B2 si le pKa du couple A1/B1 est inférieur au pKa du couple A2/B2. Si le pKa du couple A2/B2 est inférieur au pKa du couple A1/B1, c’est l’acide A2 qui réagit sur la base B2. Un acide A1 réagit d’autant plus sur une base B2 que le pKa du couple A1/B1 sera plus petit que celui du couple A2/B2. On admet que la réaction pourra être considérée comme totale si la différence entre les deux pKa est au moins de 3.
Pour prévoir les réactions acido-basiques dans le cas d’un mélange de plusieurs espèces, il faut :
- recenser les espèces mises en présence
- rechercher les couples correspondants
- classer les espèces suivant leur pKa et en déduire les espèces prédominantes
- faire réagir l’acide le plus fort sur la base la plus forte
- mettre à jour les nouvelles espèces présentes
- recommencer les deux dernières étapes jusqu’à épuisement des réactifs.
Le couple restant à la fin détermine le pH du mélange.
6 Etude de quelques indicateurs colorés
Un indicateur coloré est constitué par un couple acide – base dont les formes conjuguées ont des couleurs différentes. La zone de virage est l’intervalle de pH pour lequel l’indicateur présente une couleur intermédiaire entre la couleur de la forme acide et la couleur de sa forme basique. Les trois principaux indicateurs colorés sont :
- l’hélianthine dont la zone de virage est de 3, 1 – 4, 4
- le bleu de bromothymol dont la zone de virage est de 6, 1 – 7, 6
- la phénol-phtaléine dont la zone de virage est de 8, 1 – 10
Il faut choisir l’indicateur en fonction des réactifs. Par exemple, dans le cas du dosage d’un acide faible (acide éthanoïque, acide benzoïque, …) par une solution de soude (base forte), compte tenu de la courbe de pH obtenue en fonction du volume de la soude versée, il faut choisir un indicateur dont la zone de virage est comprise entre 6, 5 et 10. Le bleu de bromothymol et surtout la phénol-phtaléine conviennent.